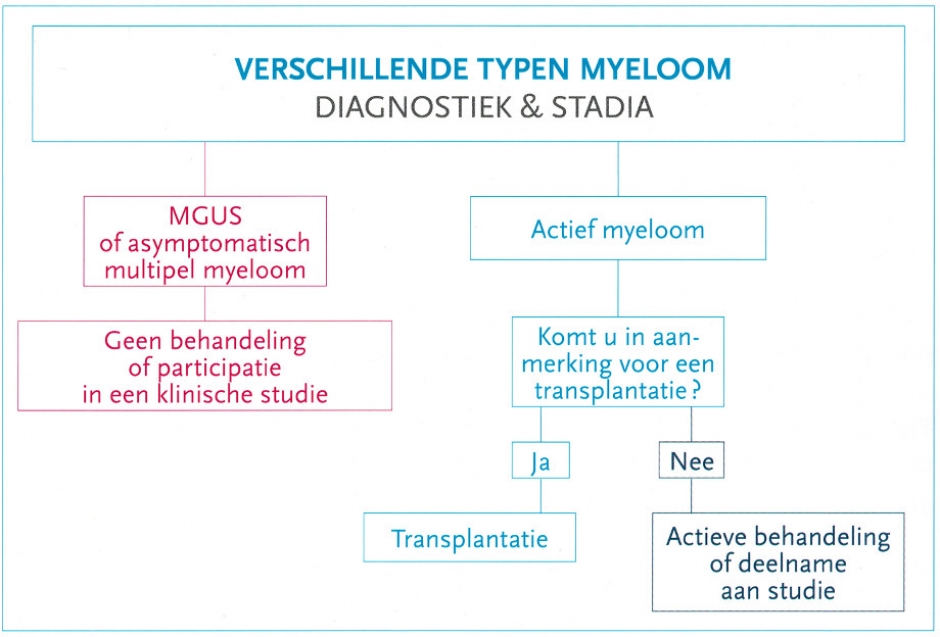
De behandelingskeuze gebeurt in functie van de leeftijd, de algemene lichamelijk conditie, eventuele eerdere behandelingen en van andere parameters.
In het algemeen worden «jonge» patiënten, jonger dan 65 jaar, anders behandeld dan oudere patiënten, 65-plussers.
De leeftijd van de patiënt is een belangrijk criterium, maar zijn algehele conditie heeft ook invloed op de behandeling. De biologische leeftijd is daarom belangrijker dan de chronologische leeftijd.
Jonge personen (jonger dan 65 jaar) ondergaan bij voorkeur een intensieve behandeling, gevolgd door een autologe transplantatie (intensieve chemotherapie gevolgd door toediening van eigen stamcellen of autotransplantatie). Omwille van de toxiciteit van deze behandeling komen enkel patiënten in goede lichamelijke conditie in aanmerking voor deze behandeling.
Bij patiënten ouder dan 65 jaar wordt deze behandeling omwille van de toxiciteit doorgaans niet voorgesteld. Patiënten die niet in aanmerking komen voor transplantatie, krijgen andere actieve behandelingen.
Er zijn twee types transplantatie: men spreekt van autologe transplantatie of autotransplantatie als uw eigen stamcellen voor de transplantatie gebruikt worden. Als de cellen afkomstig zijn van een donor spreekt men van allogene transplantatie.
Deze gebeurt in vier stappen:
De aanmaak van bloedcellen herstelt zich na ongeveer 2 weken en het ziekenhuisverblijf duurt doorgaans 2 tot 4 weken. Bij patiënten met een partiële respons kan een tweede autotransplantatie uitgevoerd worden.
De chemotherapiën voor inductiebehandeling worden voor het oogsten van stamcellen toegediend. Deze zijn de afgelopen 20 jaren sterk verbeterd.
Deze nieuwe behandelingen geven een snelle respons en hoge responscijfers. TD en RD/Rd zijn orale behandelingen met een hoger risico van bloedklontervorming (DVT=diepe veneuze trombose), waarvoor bloedverdunners gegeven moeten worden.
Bij VD en VTD wordt Velcade intraveneus toegediend. Velcade en thalidomide geven een groter risico op neuropathie. Gezeien het risico van (her)actievatie van herpes zoster (zona), wordt bij een behandeling met Velcade een antiviraal medicijn (vb. aciclovir) voorgeschreven.
Bij allogene transplantatie worden stamcellen geoogst uit het beenmerg of het perifere bloed van een donor, om ze later toe te dienen aan een patiënt. Deze donor kan een broer of zus zijn met hetzelfde weefseltype als de patiënt of eender welke donor met stamcellen die compatibel zijn met deze van de patiënt (niet-verwante donor).
Stamceltransplantatie met een donor heeft twee voordelen :
Het nadeel van transplantatie met een donor is dat de immuuncellen van de donor het organisme van de ontvanger als "vreemd" of "oneigen" kenmerken. Dit kan een ernstige verwikkeling veroorzaken, met name "graft versus host reactie" (=transplantaat tegen gastheer/ontvanger ziekte).
Deze ziekte kan levensbedreigend zijn. De meest getroffen organen zijn: de huid (huiduitslag, dermatitis), de lever (hepatitis, geelzucht) en het spijsverteringsstelsel (buikpijn, diarree). Er kunnen één of meerdere organen getroffen worden.
Het risico op infectie na een allogene transplantatie verhoogt door vele factoren. Uw arts zal u meer uitleg geven.
Chemotherapie heeft als doel de ziekte af te remmen en te controleren. Deze therapie brengt mogelijk uw ziekte onder controle (in remissie)
Tientallen jaren lang bestond de eerstelijnsbehandeling bij niet-transplantatiekandidaten enkel uit de combinatie van melfalan (chemotherapie) met prednison (corticoïde), afgekort MP.
Deze aanpak veranderde aanzienlijk met de komst van de nieuwe moleculen, zoals thalidomide, bortezomib (Velcade) en lenalidomide (Revlimid).
Heden worden Velcade® (bortezomib) of Thalidomid (Thalidomide) gecombineerd met MP als eerstelijnsbehandeling. Deze nieuwe combinaties geven betere responscijfers en een betere overleving dan MP.
De schema’s MPT (Melfalan, Prednison, Thalidomide) of MPV (Melfalan, Prednison, Velcade®) zijn vandaag referentiebehandelingen voor personen ouder dan 65 jaar. Met MPT moet soms een preventieve behandeling tegen trombose gebruikt worden door de toediening van aspirine of heparine.
De schema’s MPR (Melfalan, Prednison, Revlimid®) en RD (Revlimid®, dexamethason) bieden eveneens beloftevolle resultaten in klinische studies. Een preventieve behandeling tegen trombose is ook hier gebruikelijk.
De eerstelijnsbehandeling wordt gedurende ongeveer één jaar tot 18 maanden voortgezet of tot de respons op behandeling een plateau bereikt of stabiliseert. U kunt dan opgevolgd worden zonder een behandeling te krijgen. Eventueel kan een onderhoudsbehandeling overwogen worden.
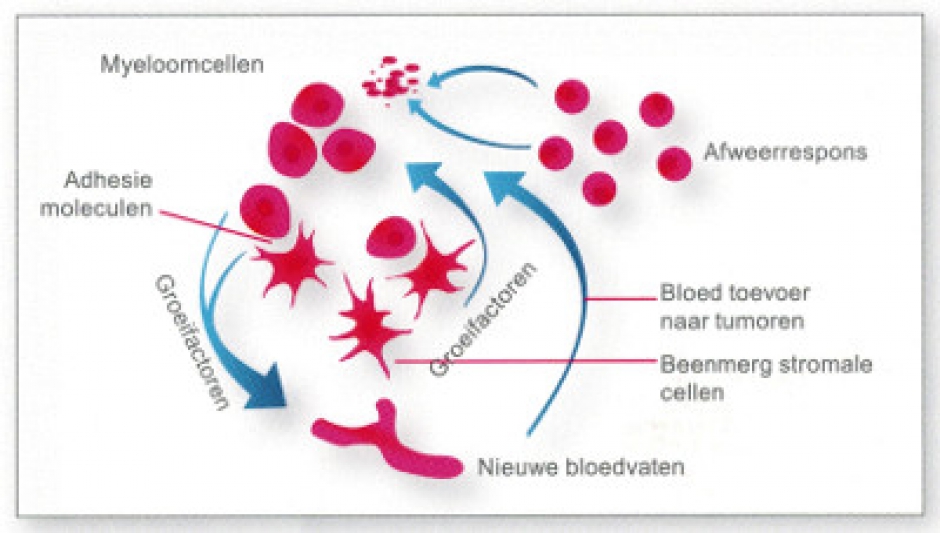
Geneesmiddelen gebruikt bij chemotherapie zijn scheikundige producten gericht op het vernietigen van kankercellen. Het zijn behandelingen die alle sneldelende cellen in het lichaam aanvallen. Groeiende myeloomcellen worden door deze geneesmiddelen vernietigd. Intraveneuze of orale toediening van deze geneesmiddelen schakelt dus een deel van de kwaadaardige plasmacellen uit en beperkt hun groei.
Deze stoffen werken echter ook in op de andere sneldelende lichaamscellen (haarcellen, darmcellen, bloedcellen), wat tevens hun bijwerkingen verklaart.
Tijdens de laatste jaren werden verschillende nieuwe geneesmiddelengroepen ontwikkeld. Zie tijdslijn op de figuur hieronder. Deze nieuwe geneesmiddelen hebben een ander werkingsmechanisme dan de klassieke chemotherapie. Onderzoek stelde vast dat de combinatie van oude geneesmiddelen voor chemotherapie met deze nieuwe geneesmiddelen de werkzaamheid en responsduur van de therapie verbetert.
Daarom combineren de meeste behandelingsschema’s meerdere geneesmiddelen van verschillende families. Enkele belangrijke families zijn de proteasoominhibitoren (OMIBs: bortezomib, carfilzomib, ixazomib), de immunomodulatoire geneesmiddelen (IMiDs: thalidomide, lenalidomide, pomalidomide), de monoclonale antibodies (UMABs: daratumumab, elotuzumab).
In een overzichtstalel, toegankelijk vanuit één van de ronddraaiende vakjes van de "NIEUWSBERICHTEN" onderaan op de home-pagina van de website, worden de huidige modaliteiten van beschikbaarheid en terugbetaling in België van elk van de geneesmiddelen samengevat. De tabel werd ons ter beschikking gesteld door dr. Karel Fostier, UZBrussel.
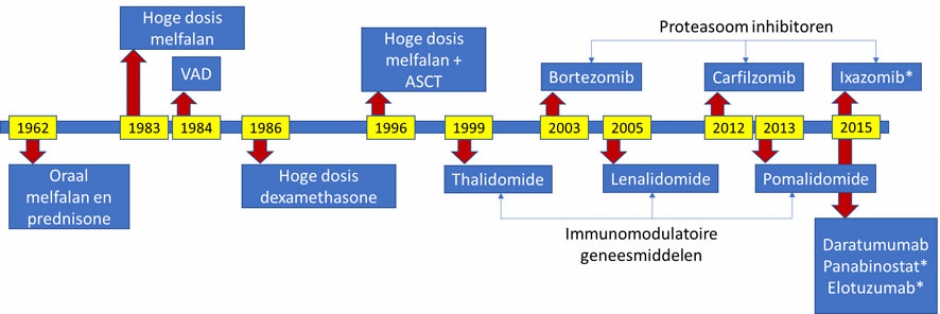
Geneesmiddelen met (*) zijn nog niet terugbetaald in België
Om de beschikbaarheid van nieuwe geneesmiddelen en combinaties zo vlot mogelijk te laten verlopen, proberen de artsen zoveel mogelijk patiënten op te nemen in studieprotocols. Dit zijn meestal multicentrische, internationale fase 3 studies waarbij patiënten gerandomiseerd worden: ofwel in de standaardbehandeling, ofwel in een nieuwe drugcombinatie.
CMP hoopt dat in samenwerking met de ziekenhuizen in de toekomst informatie over de geplande klinische studies via deze website openbaar zal kunnen gemaakt worden, zoals dat in vele andere landen reeds het geval is.
Bij de behandeling van multipel myeloom blijken bepaalde cytostatica (geneesmiddelen die de celgroei remmen = chemotherapie), met name de alkylerende geneesmiddelen, bijzonder doeltreffend. Het zijn deze alkylerende middelen, zoals melfalan of cyclosfosfamide, die gecombineerd worden met geneesmiddelen zoals cortisone en de nieuwe geneesmiddelen (thalidomide, Revlimid, Velcade).
Elk geneesmiddel heeft zijn kenmerkende bijwerkingen en eenzelfde type chemotherapie kan uiteenlopende reacties opwekken bij verschillende patiënten. De meeste bijwerking en zijn van korte duur. Ze kunnen doorgaans met gepaste medicatie bestreden worden en verdwijnen vaak van zodra de behandeling wordt beëindigd.
De vaakst voorkomende bijwerkingen met chemotherapie zijn misselijkheid en braken. Andere mogelijke bijwerkingen zijn anemie (moeheid), daling van het aantal witte bloedcellen (infectierisico), daling van het aantal bloedplaatjes (bloedingsrisico), slijmvliesontsteking (aften, diarree), haaruitval, toxiciteit van het zenuwstelsel. De meeste bijwerkingen duren niet langer dan de chemotherapie.
Velcade of bortezomib is het eerste middel van een nieuwe groep geneesmiddelen die proteasoomremmers worden genoemd. Het blokkeert het proteasoom, een systeem binnen in de cellen dat instaat voor de vernietiging van eiwitten die de cel niet langer nodig heeft. Kankercellen van het myeloom breken bepaalde eiwitten af en maken daarmee kleine stoffen, met name peptiden aan, die de groei van kwaadaardige plasmacellen bevorderen en zorgen dat ze niet afsterven. Wanneer bortezomib de afbraak van de eiwitten van de plasmacel onderdrukt, worden de tumorcellen getroffen en sterven ze af.
Het kan toegediend als inductiebehandeling of als eerstelijnsbehandeling bij patiënten die geen kandidaat zijn voor autotransplantatie, in combinatie met melfelan en prednison of met thalidimide en dexamethason alvorens een autotransplantatie wordt uitgevoerd.
Bij herval (recidive) kan het worden gebruikt samen met dexamethason of met andere geneesmiddelen (thalidomide, Revlimid, alkylerende stoffen).
Bortezomib wordt intraveneus (via de aders) toegediend.
De vaakst voorkomende bijwerkingen met Velcade zijn de volgende: infectie met virussen van de herpesfamilie (herpes, zona), trombocytopenie (daling van het aantal bloedplaatjes), perifere neuropathie met paresthesie (onprettig prikkelend, tintelend of brandend gevoel) die pijnlijk kan zijn of kan leiden tot verminderde gevoeligheid in de handen of voeten, het gevoel van koude voeten of handen terwijl ze wel warm aanvoelen, bloeddrukval bij het rechtop komen (duizeligheid), misselijkheid, diarree, braken, constipatie en moeheid
Minder vaak kan de behandeling myalgie (spierpijn), hoofdpijn, dyspneu (moeilijk ademen), anemie (daling van het aantal rode bloedcellen), neutropenie (daling van het aantal neutrofielen, een type witte bloedcellen dat infecties bestrijdt) en het ontbreken van eetlust veroorzaken.
Sinds kort is er een tweede generatie proteasoom inhibitor beschikbaar voor de hervallen patiënt, nl. carfilzomib (Kyprolis® ). Dit geneesmiddel wordt via intraveneus infuus in de regel tweemaal per week toegediend. Het inhibeert, in tegenstelling tot bortezomib, op irreversibele wijze het proteasoom. Het veroorzaakt geen neuropathie, doch kan bij een minderheid van patiënten cardiale en bloeddrukproblemen geven. Hier dient met omzichtigheid te worden gebruikt bij oudere fragiele patiënten.
Tot slot verwachten wij ook binnenkort de terugbetaling van de eerste orale proteasoom inhibitor bij hervallen patiënten, nl. ixazomib (Ninlaro®). Dit geneesmiddel wordt één maal per week ingenomen en is geassocieerd met eerder beperkte toxiciteit. Voornaamste bijwerkingen zijn tekorten aan bloedplaatjes.
Thalidomide is een stof uit de groep der immunomodulatoren (IMiDs). Het heeft een ingewikkeld werkingsmechanisme. Het blokkeert het ontstaan van kankercellen op verschillende manieren: door onderbreking van het contact tussen kankercellen en cellen uit hun omgeving (het stroma), door onderdrukking van de productie van stoffen die noodzakelijk zijn voor de groei van myeloomcellen (cytokines) en door remming van de vorming van nieuwe bloedvaten binnenin de tumor. Dankzij zijn immuunmodulerend effect stimuleert thalidomide ook gespecialiseerde cellen van het immuunsysteem (het verdedigingsstelsel van het lichaam) om de kankercellen aan te vallen. Dit kan de myeloomcellen helpen vernietigen en de ziekte-evolutie vertragen.
Het wordt gebruikt als eerstelijnsbehandeling of in latere lijnen als het myeloom niet gereageerd (refractair myeloom) of teruggekomen is (recidiverend myeloom) na een eerdere behandeling met medicatie.
Thalidomide kan worden toegepast maar wordt meestal samen met andere geneesmiddelen aangewend, zoals dexamethasone, prednisone of chemotherapie (melfalan, endoxan).
Thalidomide wordt in capsulevorm ’s avonds ingenomen, omdat het slaperigheid en draaierigheid kan veroorzaken. De dosering of het aantal capsules per dag wisselt naargelang thalidomide alleen of samen met andere geneesmiddelen wordt gebruikt. De dosering hangt ook af van de individuele verdraaglijkheid van het geneesmiddel.
Behandeling met thalidomide kan gepaard gaan met bijwerkingen zoals slaperigheid, perifere neuropathie met paresthesie (onprettig prikkelend, tintelend of brandend gevoel) die pijnlijk kan zijn of kan leiden tot verminderde gevoeligheid in de handen od voeten, constipatie, leukopenie (daling van het aantal witte bloedcellen), trombocytopenie (daling van het aantal bloedplaatjes), annemie (daling van het aantal rode bloedcellen), perifeer oedeem (zwelling, meestal van de benen) en moeheid.
Trombose kan een andere belangrijke bijwerking zijn. Bij trombose wordt een bloedklonter gevormd in een bloedvat, die zo een ader (veneuze trombose) of een slagader (arteriële trombose) verstopt.
Net zoals thalidomide is ook lenalidomide een immunomodulator (IMID).
Lenalidomide werkt op verschillende manieren in op een multipel myeloom. Het blokkeert de vorming van tumorcellen, verhindert de groei van bloedvaten in de tumoren en stimuleert ook gespecialiseerde cellen van het immuunstelsel zodat ze kankercellen aanvallen.
Het wordt gebruikt in combinatie met dexamethason als behandeling voor patiënten met multipel myeloom die minstens één eerdere behandeling hebben gekregen.
Lenalidomide wordt oraal (via de mond) toegediend onder de vorm van capsules en wordt éénmaal per dag ingenomen.
De vaakst waargenomen bijwerkingen met Revlimid® zijn de volgende: moeheid, neutropenie (daling van het aantal neutrofielen, een type witte bloedcellen dat infecties bestrijdt), constipatie, diarree, spierkrampen, anemie, (daling van het aantal rode bloedcellen), trombocytopenie (daling van het aantal bloedplaatjes in het bloed), opvliegers.
Trombose kan een andere belangrijke bijwerking zijn. Bij trombose wordt een bloedklonter gevormd in een bloedvat, die zo een ader (veneuze trombose) of een slagader (arteriële trombose) verstopt.
Pomalidomide is het jongste lid van de IMiD klasse en wordt op analoge wijze ingenomen als lenalidomide. Het bijwerkingsprofiel is eveneens vergelijkbaar, maar pomalidomide slaagt bij een deel van de patiënten erin de verworven resistentie tegen lenalidomide te overwinnen.
Sinds kort is het geneesmiddel daratumumab (Darzalex®) beschikbaar. Dit is een monoclonaal antilichaam gericht tegen CD38, een eiwit dat uitgedrukt wordt op de maligne plasmacel. Toediening van dit geneesmiddel veroorzaakt myeloom celdood. Gezien het (behalve infusie reacties) een zeer gunstig bijwerkingsprofiel vertoont, leent dit geneesmiddel zich ook perfect als toevoeging aan bestaande schema's (dit wordt nagekeken in grote fase 3 studies). In België is het tot op heden enkel beschikbaar en terugbetaald in monotherapie bij meervoudig hervallen patiënten.
Een tweede antilichaam dat een bewezen effect heeft in combinatie met vnl. lenalidomide-dexamethasone is elotuzumab. Dit antilichaam is gericht tegen CS1 (SLAMF7) en veroorzaakt een activatie van "natural killer"-cellen tegen myeloomcellen. Het is tot op heden nog niet terugbetaald.
|
Evenementenkalender
Ontdek al onze evenementen in een handig overzicht. De meest actuele evenementen vindt u hiernaast. |
Schrijf je nu in op onze CMP Nieuwsflash en blijf op de hoogte van al onze artikelen
